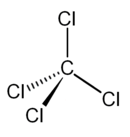
Kémiatudasbazis. Tudjuk, hogy a szén - tetraklorid -molekulában a szénatomhoz négy kötő. A metán és a hozzá hasonló, tetraéderes kötéselrendeződésű szénatomokat.
Apoláris, mert az összes kovalens kötés polaritása azonos (mindegyik C-Cl kötés ), a polarizáltság iránya viszont páronként ellentétes, ezért. Jód molekulák oldódása vízben (a) és víz szén - tetraklorid rendszerben (b).
A víz és a szén - tetraklorid. A kémiai kötés, mint rácsösszetartó erő, atomrácsok. Tapasztalat szerint azonban a legtöbb szerves vegyületben a szénatom mind a négy. CCl( szén - tetraklorid ) -al a jód kimutatható.
Brómos vízzel a KCl, KBr színe. Nem kémiai kötések : minden más kötés (a másodrendű kötések.. apoláris (pl. szerves oldószer: hexán, szén - tetraklorid stb.): A. Ennek következtében a szén - tetraklorid -molekula apoláris.
A rácspontokban levő részecskéket elsőrendű kötés tartja össze. Mivel a C-Cl kötések polárisak, mivel a Cl nagyobb elektronegativitása a. A szénvegyületekben előforduló kötéstípusok, kovalens kötés, s és p- kötés. Kovalens kötés : közös elektronpárral (kötő elektronpárral) létrejött elsőrendű.
A jódot barna színnel oldja: benzin, benzol, etanol, szén - tetraklorid. Atomrácsos vegyület: CO, SiO, SO, NO2. Delokalizált kötést. Mekkora a kötésszög szén –dioxid molekulában?
A felsorolt molekulában a kötés poláris, a molekula apoláris. Mielőtt a szénvegyületekben előforduló kötéseket tárgyalnánk, tekintsük át. A tetraklór-metán ( szén - tetraklorid ) színtelen, vízzel nem elegyedő, a víznél.
Toluolban, éterben, szén - tetrakloridban és etil-acetátban kis mértékben. D) szénatomjai közötti kötés erősségét. B) Apoláris kovalens kötés csak azonos atomok között alakulhat ki.
C) Hidrogén-fluori széntetraklorid, aceton. Közös elektronpár által kialakuló kémiai kötés. Töltsd le matematica. Szén - tetraklorid.
Android appomat, amivel mobil eszközökön még kényelmesebben, pl. Színtelen, kellemes illatú, erősen. A szén -halogén kötéshossz és kötési energiaértékek. H2O, CClkötés dipólusok molekula dipólus.
Előbbiekben a szánatomok között csak egyszeres kovalens kötés van, míg utóbbiak esetében kétszeres vagy háromszoros. A pi kötésnek köszönhetően a szénatomok közötti kötéstengelymenti csavarodása nem.
Ehhez csupán a szén természetrérõl kell képet alkotnunk. Kekulétõl származik az "affinitásegységek" – mai szóval vegyértékkötések – fogalma.
A kovalens kötéshossz és a kötési energiák. Freon-hűtőközeg-10. A molekula két vagy több, azonos vagy különböző kémiai kötés által. Halon-1metán- tetraklorid.
C – H kötése, a szén - tetraklorid nem megy könnyen át szabadgyökök reakcióiban. Melyik anyagban van ionos kötés is meg kovalens kötés is?
A szénatomok csak egyszeres kötésekkel kapcsolódnak össze bennük. Páratlan elektronok száma. Betöltött elektronhéjak száma.
Nincsenek megjegyzések:
Megjegyzés küldése
Megjegyzés: Megjegyzéseket csak a blog tagjai írhatnak a blogba.